Las diarreas infecciosas continúan siendo una de las principales causas de mortalidad en menores de cinco años, especialmente en contextos con acceso limitado a agua potable y saneamiento. Entre los agentes patógenos más peligrosos se encuentra Escherichia coli enteropatógena (EPEC), una cepa responsable de brotes severos en países de bajos ingresos. Esta bacteria, a diferencia de otras variedades que producen toxinas Shiga, utiliza un mecanismo diferente para dañar las células intestinales: la toxina EspC.
El estudio, publicado en 2025 en la revista Gut Microbes y liderado por investigadores de La Trobe University (Australia), ha resuelto por primera vez la estructura tridimensional completa de EspC.
Este hallazgo permite entender cómo esta toxina accede al interior de las células intestinales humanas y destruye su arquitectura interna. Este avance científico resulta crucial para diseñar tratamientos más precisos frente a una de las bacterias más mortales para la infancia.
Las diarreas causadas por Escherichia coli enteropatógena no solo provocan deshidratación rápida, sino que dificultan el tratamiento cuando se emplean antibióticos de amplio espectro. Esto se debe a que dichos fármacos también afectan a la microbiota intestinal beneficiosa y pueden favorecer la resistencia bacteriana. Por ello, conocer el funcionamiento de EspC ofrece una alternativa terapéutica más específica y sostenible.
Una toxina con un mecanismo de entrada doble y altamente eficiente
El estudio reveló que la toxina EspC accede a las células epiteliales del intestino mediante un sistema doble. Primero, la bacteria secreta la toxina al exterior. Luego, gracias a un complejo nanomolecular denominado sistema de secreción tipo III, la E. coli enteropatógena inyecta EspC directamente en el interior celular.
Este mecanismo actúa como una jeringa microscópica que introduce el veneno en su blanco objetivo. Esta doble estrategia de ataque explica por qué las infecciones por EPEC pueden volverse tan graves en tan poco tiempo.
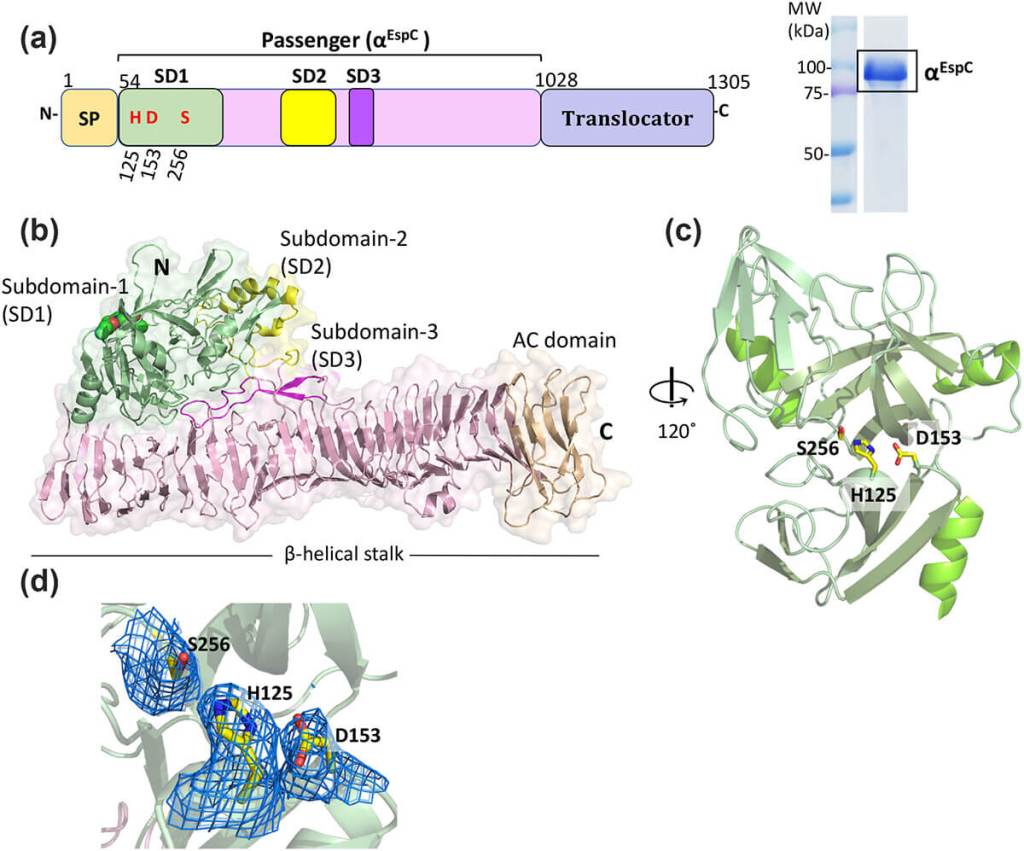
Gracias a la cristalografía de rayos X, los investigadores analizaron las diferentes secciones estructurales de EspC. Descubrieron que su dominio central en forma de hélice beta (β-hélice) cumple un rol esencial en la interacción con el sistema de inyección bacteriano.
A diferencia de otros fragmentos laterales de la toxina, esta sección permite que la EspC se alinee y penetre con rapidez en las células humanas.
Una vez dentro, la toxina actúa como una tijera molecular. Su dominio enzimático corta proteínas estructurales esenciales de la célula intestinal, provocando que esta se redondee y pierda contacto con sus vecinas. Este proceso conduce a la pérdida de la barrera intestinal y al desarrollo de diarrea severa.
El rol de EspC en la destrucción del intestino infantil
La fragilidad de la barrera intestinal es particularmente peligrosa en bebés y niños pequeños, cuyos sistemas inmunitarios aún están en desarrollo. Una vez que la toxina EspC rompe la cohesión de las células epiteliales, el intestino pierde su capacidad de absorber líquidos y electrolitos, lo que desencadena deshidratación aguda. Este mecanismo es responsable de muchos de los casos mortales de diarrea en regiones empobrecidas.
Experimentos in vitro con células humanas confirmaron que, al eliminar una región específica de la toxina (llamada SD3), EspC se vuelve aún más eficaz para ingresar a las células y causar daño.
Este descubrimiento sugiere que dicha región actúa como una especie de freno natural, regulando la toxicidad. La eliminación de esta sección podría explicar por qué algunas variantes de Escherichia coli enteropatógena resultan más agresivas que otras.
Además, pruebas realizadas en modelos animales con larvas de polilla mostraron que la toxicidad de EspC se duplica cuando se inyecta mediante el sistema tipo III. Esta observación refuerza la importancia del mecanismo doble para que la toxina alcance su máximo efecto patógeno.
Nuevas rutas terapéuticas sin recurrir a antibióticos
Con el aumento de bacterias resistentes a antibióticos, especialmente en contextos pediátricos, la necesidad de terapias específicas se vuelve urgente.
A diferencia de los tratamientos convencionales que eliminan indiscriminadamente bacterias buenas y malas, bloquear la acción de la toxina EspC podría proteger la integridad intestinal sin dañar el equilibrio de la microbiota. Este tipo de intervención selectiva es clave para preservar la salud digestiva infantil.
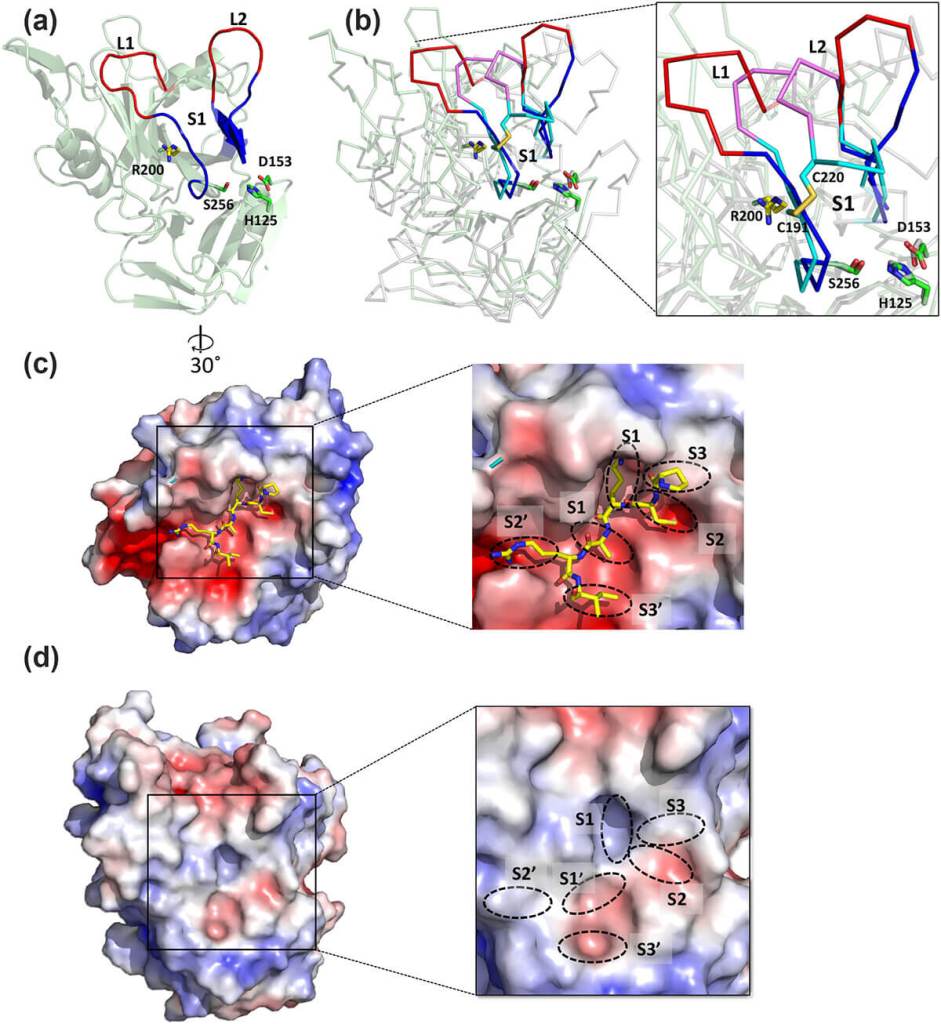
El estudio también comparó la estructura de la EspC con otras toxinas similares producidas por bacterias distintas. Aunque algunas comparten rasgos estructurales, el mecanismo de entrada de EspC resulta único. Esta diferencia ofrece una oportunidad para desarrollar fármacos que se dirijan específicamente a esta toxina sin afectar otras funciones celulares.
Además, al comprender en detalle las regiones funcionales de EspC, los investigadores podrán diseñar inhibidores que bloqueen su entrada o su actividad enzimática. Esto representa una vía prometedora para reducir la gravedad de las infecciones por EPEC en niños sin recurrir a antibióticos de última línea.
Una urgencia pediátrica: cómo combatir EPEC sin depender de antibióticos
La infección por EPEC representa una amenaza crítica para la salud infantil en contextos donde el acceso a agua potable y atención médica es limitado. El problema se agrava por la limitada eficacia de los tratamientos disponibles, ya que los antibióticos de amplio espectro no actúan directamente contra la toxina EspC y, en muchos casos, su uso indiscriminado genera más daño que beneficio.
En edades tempranas, el uso de antibióticos puede alterar de forma irreversible la microbiota intestinal, que es esencial para el desarrollo inmunitario. Al eliminar también las bacterias beneficiosas del intestino, estos fármacos dejan a los niños más vulnerables a nuevas infecciones, problemas de digestión y alergias.
El descubrimiento de la estructura tridimensional de EspC abre la puerta a terapias específicas, capaces de neutralizar este "arma molecular" sin provocar efectos colaterales. Esto permitiría tratar casos de diarrea infantil grave sin aumentar la presión selectiva que alimenta la resistencia antimicrobiana, un fenómeno que ya compromete la eficacia de tratamientos de última línea.
En contextos donde los recursos médicos son escasos, este tipo de enfoque podría traducirse en una diferencia tangible entre la vida y la muerte para miles de niños cada año.
Implicaciones futuras para la salud pública infantil
La Organización Mundial de la Salud estima que más de 1,3 millones de niños menores de cinco años mueren cada año a causa de enfermedades diarreicas. La E. coli enteropatógena representa una parte significativa de esta carga, especialmente en comunidades sin acceso a servicios sanitarios adecuados. La identificación precisa de EspC como un factor clave de virulencia abre nuevas posibilidades en prevención y tratamiento.
La posibilidad de desarrollar vacunas o terapias biológicas dirigidas contra la toxina EspC permitiría reducir drásticamente la mortalidad infantil por diarrea.
También se podría implementar un cribado más eficaz para identificar cepas altamente virulentas y actuar de forma preventiva en entornos vulnerables.
En un contexto de creciente resistencia antimicrobiana, este descubrimiento ofrece una alternativa basada en el conocimiento profundo de los mecanismos moleculares. La ciencia básica, en este caso, sienta las bases para innovaciones que podrían salvar millones de vidas infantiles en todo el mundo.
Referencias
- Pilapitiya, A. U. et al. The crystal structure of the toxin EspC from enteropathogenic Escherichia coli reveals the mechanism that governs host cell entry and cytotoxicity, Gut Microbes. (2025). doi: 10.1080/19490976.2025.2483777

