Las placentas de niños y niñas presentan patrones moleculares distintos desde el embarazo, y estos podrían explicar diferencias en el crecimiento fetal y la salud futura. Un nuevo estudio sugiere que estos cambios epigenéticos podrían actuar como "puentes biológicos" entre el sexo fetal y el riesgo de enfermedades a lo largo de la vida.
El estudio, publicado en 2025 en la revista Nature Communications, fue liderado por un equipo del Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD), perteneciente a los Institutos Nacionales de Salud (NIH) de Estados Unidos. A través de un análisis genómico, epigenético y transcriptómico de más de 300 placentas humanas, los investigadores exploraron cómo el sexo fetal modula la regulación molecular de este órgano clave para el desarrollo.
Los hallazgos revelan que las diferencias entre niños y niñas comienzan desde la vida intrauterina y podrían tener implicaciones duraderas en el crecimiento, el metabolismo y el riesgo de enfermedades en la edad adulta.
El papel silencioso de la placenta en las diferencias entre hombres y mujeres
Desde antes de nacer, los organismos masculinos y femeninos siguen trayectorias biológicas distintas. La placenta, órgano clave durante el embarazo, no solo refleja esas diferencias sino que también podría influir en ellas mediante mecanismos epigenéticos como la metilación del ADN. Esta regulación no altera los genes, pero puede silenciarlos o activarlos.
El equipo analizó datos genómicos, de metilación y expresión génica de más de 300 placentas humanas de embarazos normales.
Identificaron miles de sitios del ADN con patrones de metilación que varían según el sexo del feto, y observaron que muchos de estos estaban vinculados a genes implicados en el crecimiento fetal y enfermedades comunes.
Uno de los hallazgos centrales fue que la metilación difiere mucho más que la expresión génica entre sexos en la placenta, lo que sugiere que las diferencias epigenéticas son una vía principal de diferenciación temprana entre niños y niñas.
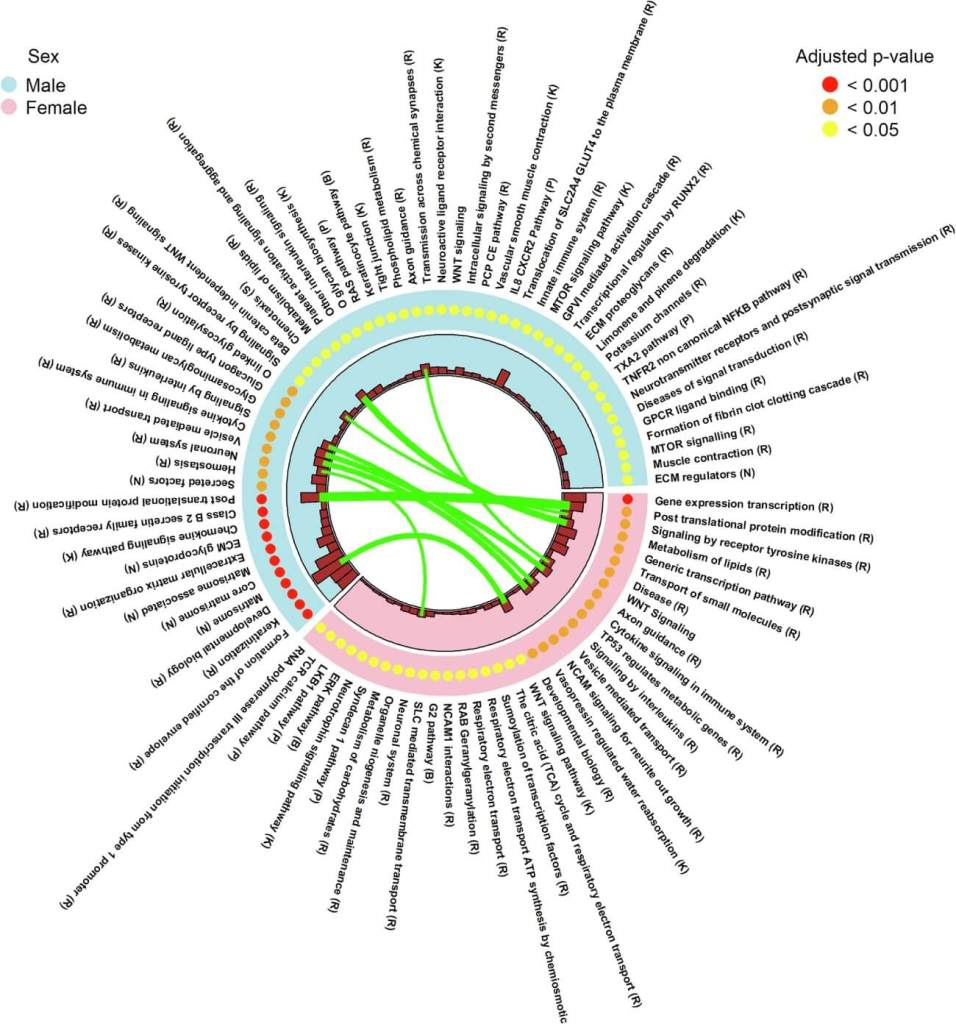
Casi 7000 sitios del ADN difieren entre placentas masculinas y femeninas
Los investigadores detectaron 6077 sitios CpG (regiones del ADN donde se produce metilación) con diferencias significativas entre sexos. De ellos, el 66,9 % estaban hipermetilados en placentas masculinas, y solo el 33,1 % en las femeninas. Casi la mitad de estos sitios no habían sido identificados antes.
Estas marcas epigenéticas están lejos de ser aleatorias. Los sitios sexoespecíficos mostraron una mayor probabilidad de correlacionarse con la expresión de genes cercanos que los sitios neutrales, lo que sugiere un papel funcional en la regulación del desarrollo fetal.
Además, el patrón de correlación dependía del contexto genómico: la metilación en promotores solía estar asociada a menor expresión, mientras que en regiones internas de genes se relacionaba con mayor actividad génica.
Genes relacionados con crecimiento fetal, placenta e incluso cáncer
Entre los genes afectados por metilación diferencial se encontraron ZNF300, CSMD1 y CADM2, implicados en procesos de proliferación celular y crecimiento tisular. Muchos de ellos también están vinculados a enfermedades como preeclampsia, parto prematuro y trastornos metabólicos.
Un caso notable fue el gen FNDC5, relacionado con la producción de irisin, una proteína que protege la placenta contra el estrés oxidativo y la resistencia a la insulina. Su expresión se redujo en placentas masculinas con alta metilación, lo que podría asociarse a un mayor riesgo de disfunción placentaria.
Los investigadores también encontraron asociaciones entre la metilación de ciertos genes y rasgos neonatales.
Las placentas masculinas con mayor metilación tendieron a estar relacionadas con bebés más grandes, mientras que en placentas femeninas se asoció con mayor peso placentario.
Efectos genéticos que dependen del sexo: un nuevo horizonte para la medicina personalizada
La metilación también estuvo influida por variantes genéticas específicas, pero de forma distinta según el sexo fetal. Se identificaron 1.839 asociaciones genéticas con patrones de metilación (sex-mQTL), muchas de las cuales solo se manifestaban en uno de los dos sexos.
Por ejemplo, una variante genética cerca del gen CCDC6 estuvo asociada a mayor metilación solo en placentas masculinas, y este gen se ha vinculado previamente con partos prematuros.
En cambio, variantes en NRF1 afectaron la metilación solo en placentas femeninas, y este gen regula la función mitocondrial placentaria.
Estos hallazgos demuestran que el sexo fetal modula cómo el ADN responde a las variantes genéticas, lo que podría tener implicaciones importantes para entender enfermedades que muestran diferencias entre hombres y mujeres.
Impronta genética: cómo el sexo influye en la herencia epigenética
Una de las secciones más llamativas del estudio fue el hallazgo de una enriquecida metilación en genes impresos según el sexo fetal, especialmente en el dominio KCNQ1OT1/CDKN1C, clave en el crecimiento fetal y en síndromes como Beckwith-Wiedemann.
Este clúster presentó múltiples sitios hipermetilados en placentas femeninas, lo que se asoció con mayor expresión de genes maternos como CDKN1C y menor expresión de genes paternos como KCNQ1, dependiendo del sexo del feto.
Estas diferencias podrían explicar por qué las niñas presentan mayor proporción de placenta respecto al peso al nacer, mientras que los niños, con menor metilación en esos mismos sitios, tienden a nacer con mayor peso corporal.
De la placenta al futuro: cómo el sexo fetal marca la salud adulta
Los autores encontraron que muchos de los sitios y genes identificados están relacionados con rasgos como el peso al nacer, talla, circunferencia cefálica y riesgos futuros como el asma, el cáncer o el rendimiento cognitivo.
Variantes en los genes ATP5MG y FAM83A, con expresión específica en placentas femeninas, se asociaron con mayor riesgo de eccema, asma y cáncer de mama en mujeres adultas.
Por su parte, otras asociaciones en varones vincularon genes placentarios con logros educativos y enfermedades metabólicas.
Estos datos apoyan la hipótesis de que las diferencias sexuales en la placenta son una de las raíces moleculares de las desigualdades en salud a lo largo de la vida, y que intervenir sobre ellas podría tener beneficios en medicina preventiva.
El sexo importa desde la placenta
Este estudio demuestra que las diferencias entre hombres y mujeres comienzan en la placenta y están moduladas por mecanismos epigenéticos y genéticos complejos. La metilación diferencial, la expresión génica y la impronta genética están profundamente influenciadas por el sexo fetal.
Estas diferencias no solo afectan el desarrollo prenatal, sino que están relacionadas con rasgos neonatales y enfermedades del adulto.
Los resultados ofrecen una vía para entender mejor la biología del embarazo, las complicaciones fetales y las desigualdades en salud según el sexo.
Con una metodología robusta y análisis multiómicos, esta investigación da un paso firme hacia una medicina más personalizada, que tenga en cuenta el sexo como variable biológica fundamental desde la vida intrauterina.
Referencias
- Tekola-Ayele, F., Biedrzycki, R.J., Habtewold, T.D. et al. Sex-differentiated placental methylation and gene expression regulation has implications for neonatal traits and adult diseases. Nat Commun 16, 4004 (2025). doi: 10.1038/s41467-025-58128-3




