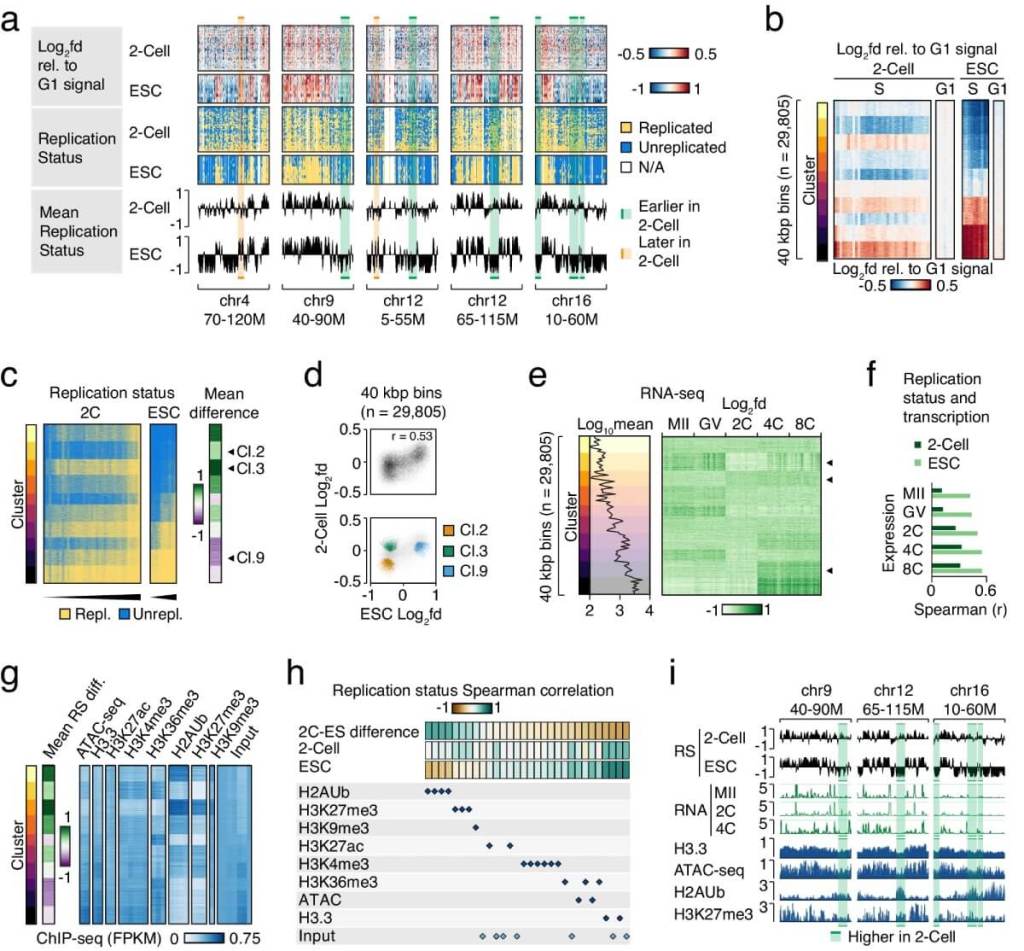
Durante los primeros instantes del desarrollo embrionario, el material genético heredado del óvulo y del espermatozoide no se comporta de manera idéntica. Un nuevo estudio realizado en embriones de ratón revela que la replicación del ADN —el proceso por el cual las células duplican su contenido genético— ocurre de forma distinta en los genomas materno y paterno justo después de la fecundación. Este descubrimiento pone en evidencia que, lejos de ser simétrico, el inicio del ciclo celular embrionario está marcado por una asincronía sorprendente.
En el cigoto, que es la primera célula resultante de la fecundación, la replicación del ADN no sigue el patrón ordenado que se observa en células más maduras. Los investigadores encontraron que esta célula inicial carece de un “programa de replicación” convencional, lo que significa que el ADN se copia de forma generalizada y sin la secuencia jerárquica habitual. Sin embargo, al llegar a la etapa de dos células, este programa comienza a establecerse y muestra diferencias notables entre los genomas heredados de cada progenitor.
La investigación, liderada por científicos del University of Copenhagen y publicada en Nature Communications, utilizó una innovadora técnica de secuenciación llamada Repli-seq adaptada para embriones individuales. Gracias a esta herramienta, fue posible observar con alta precisión cómo se replica el ADN en cada una de las dos copias del genoma: la materna y la paterna.
Lo que encontraron sugiere que la herencia epigenética —modificaciones químicas previas en el ADN y las proteínas asociadas— influye activamente en el ritmo de replicación de cada genoma.
El genoma materno replica más lento en regiones clave del ADN
Una de las diferencias más marcadas se detectó en las regiones pericentroméricas del ADN, zonas cercanas al centro de los cromosomas que son cruciales para una división celular ordenada. En los embriones de dos células, estas regiones del genoma materno replican considerablemente más tarde que sus equivalentes paternas.
Esta diferencia temporal podría ser un factor de riesgo en el desarrollo, ya que las regiones pericentroméricas suelen ser más propensas a sufrir daños genéticos si la replicación no se produce de forma precisa y sincronizada.
El estudio también encontró que, a pesar de esta lentitud en ciertas zonas, otras áreas del genoma materno se replican antes de lo esperado, desafiando las reglas típicas de la biología celular. Específicamente, las regiones que en teoría deberían replicarse tarde por su ubicación en compartimentos genómicos “inactivos” (compartimentos B) lo hacen de forma anticipada. Esta paradoja se explica por la presencia de modificaciones epigenéticas heredadas del ovocito, como la marca H3K27me3, que parece acelerar la replicación en ciertas regiones.
Estos hallazgos sugieren que el genoma materno no solo replica más lentamente en zonas críticas, sino que también contiene segmentos que escapan a las reglas tradicionales. El patrón de replicación parece estar influido por una “memoria epigenética” que se arrastra desde el óvulo fecundado y afecta la organización tridimensional del ADN dentro del núcleo embrionario.
El programa de replicación no se hereda, se construye desde cero
El análisis de los investigadores mostró que en el cigoto, es decir, antes de que la célula se divida por primera vez, no existe un programa de replicación definido. A diferencia de lo que ocurre en células madre embrionarias más avanzadas, el ADN del cigoto parece replicarse de manera uniforme, sin un orden jerárquico evidente. Esto indica que el embrión debe crear de forma autónoma su programa de replicación, lo cual ocurre gradualmente a partir de la etapa de dos células.
Este proceso de establecimiento está estrechamente vinculado a la activación del genoma embrionario, un hito clave en el desarrollo en el que se “encienden” por primera vez los genes del embrión. Además, la organización del genoma en compartimentos A y B —estructuras tridimensionales que marcan regiones activas e inactivas del ADN— comienza a emerger en paralelo con este nuevo programa de replicación. De este modo, la replicación del ADN no solo es una copia de la información genética, sino también un reflejo de la arquitectura nuclear en formación.
Aunque ambos genomas parentales terminan adoptando una estructura similar en etapas posteriores, los investigadores observaron que durante estas primeras divisiones existe una clara separación funcional.
El hecho de que las regiones del genoma paterno y materno sigan ritmos distintos de replicación apunta a una asimetría estructural y temporal, probablemente influida por los diferentes estados epigenéticos que cada uno hereda desde el gameto original.
La herencia epigenética materna deja una huella duradera
Un aspecto clave del estudio fue el análisis de marcas epigenéticas heredadas del ovocito, en particular las depositadas por los complejos Polycomb, conocidos por su papel represor en la regulación de genes. Estas marcas, especialmente H3K27me3, estaban presentes en muchas de las regiones que replicaban temprano en el genoma materno, incluso si esas regiones pertenecían a compartimentos “inactivos” del ADN.
Los datos sugieren que estas señales epigenéticas no solo sobreviven a la fecundación, sino que influyen activamente en el momento y el orden de replicación del ADN.
De hecho, la combinación de esta información heredada con la nueva arquitectura nuclear del embrión parece definir el paisaje de replicación en las primeras fases del desarrollo. En contraste, el genoma paterno mostró una asociación mucho más débil entre las marcas epigenéticas y la replicación temprana.
Esta diferencia pone en evidencia un control asimétrico entre los dos genomas, donde la historia epigenética de la madre tiene un papel más dominante en organizar la replicación del ADN. Es probable que esta influencia temprana afecte también la forma en que se activan los genes embrionarios, lo cual podría tener implicaciones duraderas en el desarrollo posterior.
La compartimentalización del ADN y su vínculo con la replicación
A medida que el embrión alcanza la etapa de dos células, su ADN comienza a organizarse en dominios tridimensionales conocidos como compartimentos A y B. Esta estructura espacial determina qué partes del genoma estarán más activas y cuáles se mantendrán reprimidas. En las células madre embrionarias, ya se sabe que la replicación del ADN está estrechamente asociada con esta compartimentalización: las regiones activas replican temprano y las inactivas, más tarde.
En los embriones analizados, los investigadores encontraron que esta relación ya empieza a manifestarse desde muy temprano. Tanto el genoma materno como el paterno mostraron una correlación con los compartimentos, aunque el genoma materno exhibía un patrón peculiar: algunas regiones ubicadas en el compartimento B —teóricamente inactivo— replicaban de manera anticipada.
Este comportamiento anómalo se explicaba por la presencia simultánea de marcas H3K27me3, lo que indica que la ubicación nuclear y la herencia epigenética actúan de forma independiente para determinar el momento de replicación.
Estos resultados aportan una nueva dimensión al estudio del desarrollo embrionario: no basta con observar dónde está un gen en el espacio del núcleo, sino también qué marcas químicas heredadas lo acompañan. Esta doble influencia —estructura y epigenética— determina cómo se comporta el ADN y sugiere que la arquitectura del genoma se está formando mientras el embrión ya está en proceso de replicación.
Implicaciones para la fertilidad, la replicación y los errores cromosómicos
Las diferencias en el tiempo de replicación entre el ADN materno y paterno no son meros matices técnicos: podrían estar en el origen de errores genéticos que derivan en fallos del desarrollo embrionario temprano. En concreto, la replicación tardía en las regiones pericentroméricas maternas —áreas clave para la correcta segregación de los cromosomas— podría aumentar la vulnerabilidad a rupturas o fallos en la división celular, lo que a su vez puede producir aneuploidías o abortos espontáneos.
Estos hallazgos resultan especialmente relevantes en el contexto de la fecundación in vitro (FIV). Al conocer mejor los momentos críticos de replicación en el embrión temprano, podrían diseñarse estrategias para minimizar el estrés replicativo y, con ello, aumentar la tasa de éxito de los tratamientos de fertilidad.
Además, las tecnologías emergentes podrían permitir seleccionar embriones con patrones de replicación más sincronizados y robustos.
Otro punto importante es que el estudio abre la puerta al análisis de cómo los factores paternos y maternos afectan de forma desigual al desarrollo. El hecho de que el genoma materno esté más influido por marcas epigenéticas sugiere que su “memoria” biológica podría jugar un papel clave en determinar qué genes se activan primero y con qué ritmo se replica el ADN.
Este conocimiento será fundamental para entender por qué algunos embriones fallan en sus primeras divisiones, incluso cuando no presentan mutaciones visibles.
Un nuevo paradigma en la biología del embrión humano
El descubrimiento de un programa de replicación asincrónico entre el genoma materno y paterno marca un cambio de paradigma en nuestra comprensión del desarrollo temprano. Hasta ahora, se asumía que el embrión comenzaba su vida celular con una replicación simétrica y coordinada.
Este estudio demuestra que no es así: la replicación es desordenada en el cigoto, se vuelve más estructurada en la etapa de dos células, y está profundamente influenciada por factores heredados y organización nuclear.
A nivel científico, este trabajo plantea nuevas preguntas sobre los mecanismos que permiten al embrión superar esta fase crítica. ¿Cómo se corrigen las diferencias iniciales de replicación entre los genomas? ¿Qué papel juega el estrés replicativo en la aparición de defectos genéticos? ¿Se pueden diseñar intervenciones clínicas basadas en estos patrones?
A nivel clínico, los resultados podrían ser decisivos para el futuro de la medicina reproductiva. Identificar con precisión las fases más vulnerables del desarrollo podría mejorar el diseño de medios de cultivo, los tiempos de transferencia embrionaria y las estrategias de selección de embriones en tratamientos de fertilidad. En última instancia, comprender cómo se replica el ADN de cada progenitor nos acerca un paso más a entender por qué algunos embriones prosperan y otros no.
Referencias
- Halliwell JA, Martin-Gonzalez J, Hashim A, Dahl JA, Hoffmann ER, et al. Sex-specific DNA-replication in the early mammalian embryo. Nat Commun. (2024). doi:10.1038/s41467-024-50727-w




