Cuando, tras meses de incertidumbre, un niño o niña recibe un diagnóstico de TEA, para muchas familias, comienza una nueva etapa marcada por preguntas cruciales. ¿Cómo evolucionará su desarrollo? ¿Necesitará apoyo especializado? ¿Será capaz de comunicarse, desenvolverse con autonomía, o aprender al ritmo de otros niños? Durante años, estas preguntas acerca del trastorno del espectro autista han quedado sin una respuesta clara. Y la ciencia sigue intentando encontrar respuestas.
Aunque los primeros signos del trastorno del espectro autista suelen aparecer entre los 18 y 36 meses de edad, la discapacidad intelectual (DI), que afecta a entre el 10% y el 40% de los niños con autismo, solo puede diagnosticarse con cierta fiabilidad después de los seis años.
Ahora, un equipo internacional de investigadores ha desarrollado un modelo que podría cambiar esta realidad. Publicado este mes de abril de 2025 en JAMA Pediatrics, el estudio liderado por Vincent-Raphaël Bourque y colaboradores ha demostrado que combinar información genética con los hitos del desarrollo infantil permite anticipar la probabilidad de que un niño o niña con TEA desarrolle discapacidad intelectual.
Este hallazgo no solo tiene implicaciones clínicas, sino también emocionales y logísticas para las familias, que podrían contar con herramientas más precisas para tomar decisiones informadas desde edades tempranas. Es una nueva puerta al conocimiento del TEA que la ciencia abre para el futuro.

Detalles de un estudio trascendente para el futuro del TEA
El estudio se basa en datos de tres grandes cohortes de investigación sobre el trastorno del espectro autista: SPARK, Simons Simplex Collection y MSSNG. En total, se analizaron los datos de 5.633 niños y niñas con diagnóstico confirmado de TEA, que fueron evaluados posteriormente para determinar si presentaban discapacidad intelectual.
Los investigadores desarrollaron modelos predictivos que incorporan dos tipos de variables principales:
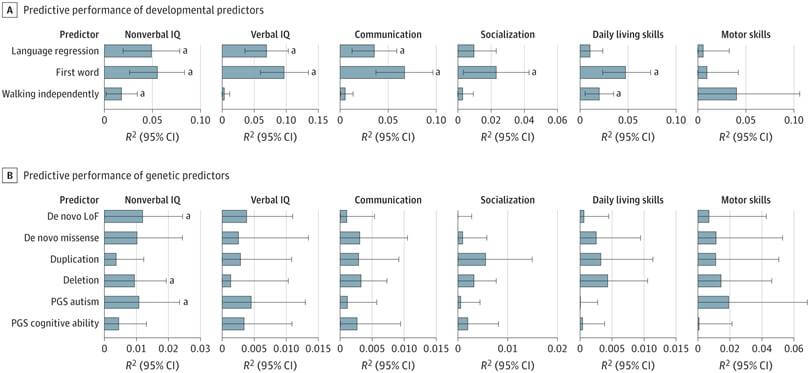
- Datos del desarrollo infantil: edad en que el niño empezó a caminar, dijo sus primeras palabras, formó frases, controló esfínteres o si presentó regresión del lenguaje.
- Información genética: incluye tanto variantes raras de alto impacto (como deleciones o mutaciones espontáneas en genes relacionados con el neurodesarrollo), como puntuaciones poligénicas (PGS) que indican predisposición genética a ciertos rasgos como la capacidad cognitiva.
Estos modelos fueron entrenados y validados con métodos de aprendizaje automático y estadística robusta, como regresión logística y validación cruzada en 10 pliegues. Además, se probó su generalización en diferentes cohortes para asegurar su aplicabilidad a distintos contextos clínicos.
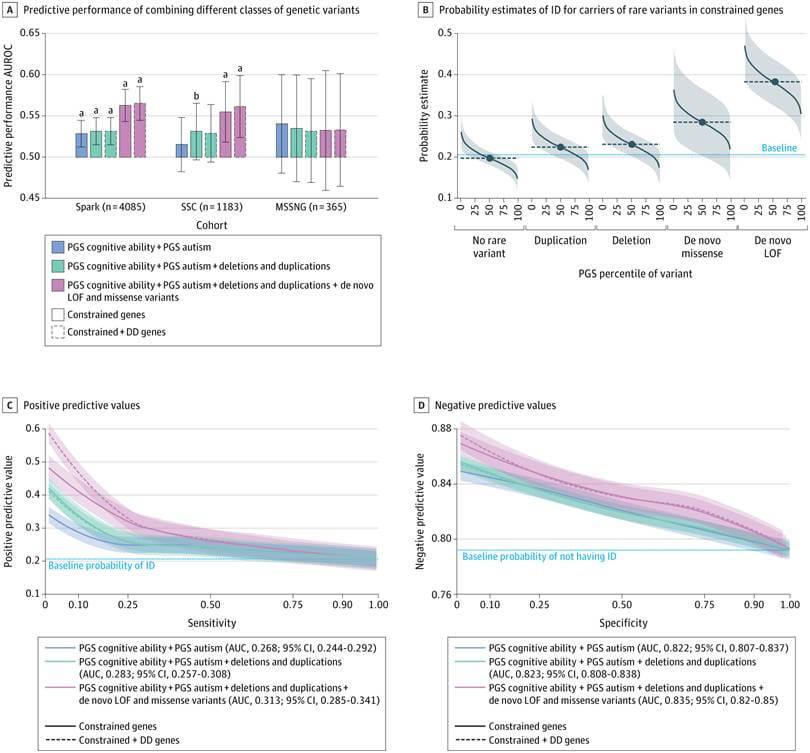
Al integrar ambos tipos de datos, los modelos alcanzaron una capacidad predictiva (AUROC) de 0,65. Aunque esta cifra no representa una certeza absoluta, sí mejora significativamente respecto a usar solo uno de los factores por separado. En concreto, el modelo logró estos tres hitos:
- Identificar correctamente al 10% de los niños que desarrollaron DI.
- Obtener valores predictivos positivos del 55% para ciertas combinaciones de factores genéticos.
- Mejorar la capacidad de descartar la presencia futura de DI cuando se incluía información genética junto a hitos del desarrollo (valores predictivos negativos de hasta 89%).
Además, se comprobó que el modelo tenía un mayor valor predictivo en niños que mostraban retrasos tempranos en el desarrollo, como caminar después de los 18 meses o primeras palabras tardías, aumentando así la precisión cuando más se necesita.
Cómo puede ayudar a las familias: crianza, educación y apoyo
Para madres y padres, estos modelos pueden representar un cambio de paradigma. En lugar de esperar varios años para ajustar apoyos o terapias, podrían anticiparse a las necesidades futuras de sus hijos e hijas.
Por ejemplo, si un niño presenta un retraso en el desarrollo del lenguaje y se detectan variantes genéticas asociadas a mayor riesgo de DI, se podría ofrecer desde muy temprano una atención especializada. Esto puede reducir el impacto emocional de una posible discapacidad intelectual futura y aumentar las oportunidades de intervención eficaz.
También puede ser útil para planificar el entorno educativo: centros con apoyos específicos, adaptación curricular o acceso a programas individualizados de aprendizaje. En este sentido, la colaboración entre equipos médicos, educativos y las familias podría facilitar una transición escolar más adaptada desde la etapa infantil.
Los autores destacan que el modelo no debe usarse de forma determinista, sino como una herramienta más en la valoración global del niño. De hecho, muchos de los factores genéticos analizados ni siquiera son considerados relevantes hoy día por los laboratorios clínicos, pero al combinarse con datos del desarrollo cobran valor predictivo.
Como recuerda la Comisión Lancet sobre autismo (2022), la intervención temprana y personalizada es uno de los pilares clave para mejorar el bienestar de las personas autistas y sus familias. Esta investigación podría facilitar esa personalización desde el inicio.

El modelo también podría aliviar la ansiedad de muchas familias, al ofrecer una estimación más clara del panorama futuro. No se trata de etiquetar ni condicionar, sino de aportar claridad en un momento de máxima incertidumbre.
Desde una perspectiva ética, los autores subrayan la importancia de informar adecuadamente a las familias sobre el significado de estos resultados y evitar interpretaciones fatalistas. La predicción, explican, debe servir para abrir puertas, no para cerrarlas.
Referencias
- Vincent-Raphaël Bourque, Zoe Schmilovich, Guillaume Huguet, et al. Genomic and Developmental Models to Predict Cognitive and Adaptive Outcomes in Autistic Children. JAMA Pediatrics, 2025. DOI: 10.1001/jamapediatrics.2025.0205
- The Lancet Commission on the future of care and clinical research in autism, 2022.



