Durante el embarazo, el feto y la madre mantienen una cooperación constante, pero también una tensión evolutiva. El feto necesita nutrientes para crecer, mientras que la madre busca mantener un equilibrio que le permita sobrevivir, parir y reproducirse nuevamente. Esta relación está mediada por la placenta, un órgano transitorio que regula el intercambio de sustancias entre ambos.
Un estudio publicado en la revista Cell Metabolism, liderado por investigadores de la Universidad de Cambridge, revela cómo un gen de origen paterno, Igf2, cumple un papel central en este proceso. El gen está activo en las células endocrinas de la placenta y permite que el feto altere el metabolismo de su madre para redirigir glucosa y lípidos hacia su crecimiento.
El equipo demostró que al eliminar Igf2 de la placenta en ratones, las madres no desarrollaban resistencia a la insulina y los fetos nacían con menor peso y niveles bajos de glucosa. Este fenómeno también afectó el metabolismo de la descendencia en la edad adulta.
La placenta como interfaz hormonal y epigenética
La expresión de Igf2 está regulada por un mecanismo llamado impronta genómica. Solo la copia paterna del gen se activa en las células endocrinas de la placenta, mientras que la copia materna permanece silenciada. Esto permite al feto influir sobre su madre sin interferencia directa de sus propios genes maternales.
El estudio utilizó una estrategia de edición genética con tecnología Cre-LoxP para eliminar Igf2 de la zona denominada "junctional zone" de la placenta (Jz), compuesta por células endocrinas. Los investigadores analizaron camadas completas de ratones modificados genéticamente, lo que permitió observar efectos consistentes sin interferencia de genotipos mixtos.
Los resultados mostraron que la eliminación de Igf2 no alteró la estructura de la placenta, pero sí redujo la producción de hormonas como las prolactinas y afectó la capacidad de la placenta para enviar señales al cuerpo materno. Esto derivó en una menor disponibilidad de glucosa y lípidos para el feto.

Impacto sobre la resistencia a la insulina en el embarazo
Durante el embarazo, el cuerpo materno desarrolla resistencia a la insulina de forma fisiológica. Este cambio permite que más glucosa quede libre en la sangre y llegue al feto a través de la placenta. Sin embargo, en las madres que gestaban fetos sin Igf2 en su placenta, este mecanismo no se activó correctamente.
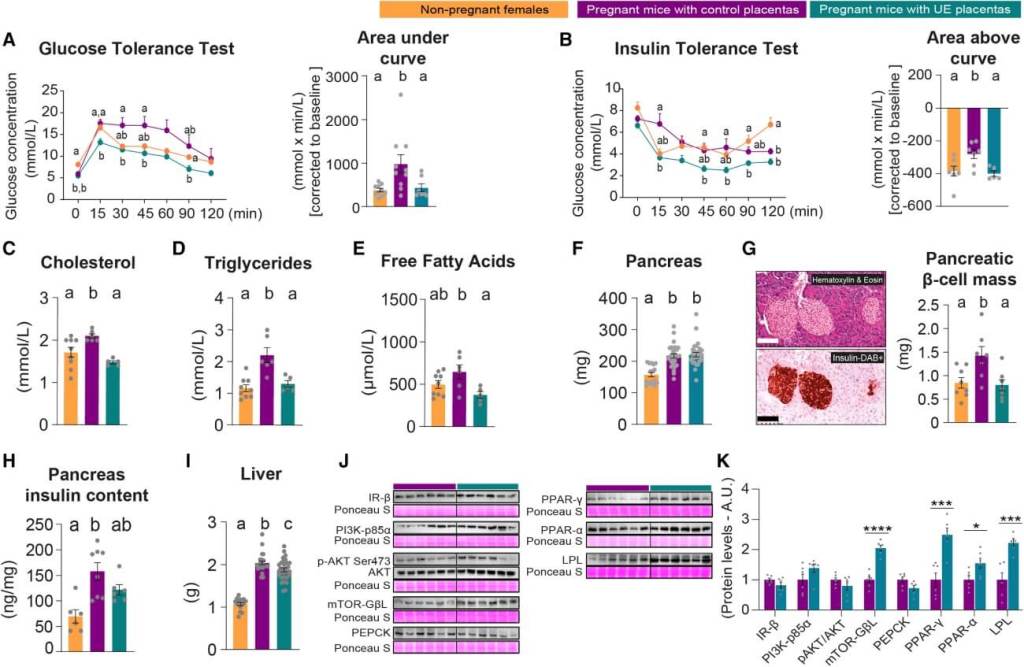
Las pruebas de tolerancia a la glucosa e insulina demostraron que estas madres mantenían una sensibilidad a la insulina similar a la de hembras no gestantes.
También se observó una falta de aumento en los niveles circulantes de colesterol, triglicéridos y ácidos grasos, lo cual impide la movilización de reservas energéticas hacia el feto.
Otro hallazgo relevante fue la ausencia de expansión de las células beta pancreáticas en estas madres. Este proceso normalmente ocurre en la gestación como respuesta al incremento en las demandas metabólicas, y está mediado por hormonas placentarias como la prolactina, cuya producción fue disminuida en los animales mutantes.
Un perfil hormonal alterado en la madre
El análisis del plasma materno reveló una alteración en el perfil hormonal. Aunque los niveles de IGF2 circulante no se vieron afectados, se detectó un aumento en la relación estradiol/progesterona, lo que indica un desequilibrio en la síntesis de esteroides placentarios.
Mediante espectrometría de masas, se identificaron 80 proteínas de origen placentario en la sangre materna. Las madres con placentas deficientes en Igf2 presentaban niveles significativamente más bajos de prolactina y kallistatina, dos hormonas implicadas en la regulación metabólica e insulínica.
Además, algunas proteínas como VTNC y CFB mostraban niveles intermedios entre gestantes normales y hembras no gestantes.
Estos cambios sugieren que el feto, a través del gen Igf2, regula indirectamente la composición hormonal de la sangre materna para favorecer su propio crecimiento. La ausencia de esta señal endocrina impide que el cuerpo materno se adapte adecuadamente a la gestación.
Efectos celulares y moleculares en la placenta
Para profundizar en los mecanismos implicados, se cultivaron células endocrinas placentarias de animales normales y mutantes. El análisis del secretoma reveló 1.408 proteínas, muchas de ellas con funciones hormonales, metabólicas y reproductivas.
La comparación mostró que el 68% de las proteínas secretadas únicamente por las placentas deficientes en Igf2 estaban relacionadas con procesos metabólicos.
Además, se encontraron diferencias cualitativas en la presencia de factores implicados en el metabolismo de grasas y glucosa, así como en la proliferación de células β del páncreas.
Consecuencias a largo plazo en la descendencia
El estudio también evaluó el impacto del ambiente intrauterino en la salud posterior de la descendencia. Los ratones nacidos de placentas sin Igf2 fueron alimentados con dieta normal o alta en azúcar y grasa tras el destete.
Independientemente de la dieta, todos los descendientes de placentas mutantes desarrollaron resistencia a la insulina. Aquellos alimentados con dieta obesogénica mostraron mayor ganancia de grasa corporal y alteraciones en los niveles de colesterol y triglicéridos, especialmente los machos.
El análisis hepático mostró una alteración en los niveles de proteínas clave del metabolismo, como PI3K, AKT, PPARγ y PEPCK.
Estos cambios se asociaron con una mayor susceptibilidad a disfunción metabólica inducida por la dieta en la vida adulta, lo que sugiere un efecto programador del ambiente placentario temprano.

El gen Igf2 como pieza clave en la adaptación materna
La investigación aporta evidencia de que el gen Igf2 actúa como un "sistema de manipulación fetal", capaz de alterar el metabolismo materno a través de hormonas placentarias. Su ausencia impide que se establezcan mecanismos adaptativos como la resistencia a la insulina, la movilización de lípidos o la expansión pancreática.
Este hallazgo tiene implicaciones para entender patologías del embarazo como la diabetes gestacional, la restricción del crecimiento intrauterino o incluso el riesgo de enfermedades metabólicas en la adultez.
El estudio demuestra que el equilibrio entre genes maternos y paternos en la placenta influye en la salud de la madre y del hijo a largo plazo.
Futuros estudios podrán explorar cómo otras proteínas placentarias participan en esta programación fetal y cómo podría intervenirse para mejorar los resultados de salud durante y después del embarazo.
Referencias
- Lopez-Tello J, Yong HEJ, et al. Fetal manipulation of maternal metabolism is a critical function of the imprinted Igf2 gene. Cell Metab. (2023). doi:10.1016/j.cmet.2023.06.007