¿Por qué el embarazo humano tiene tanto éxito biológico y, al mismo tiempo, es tan vulnerable a complicaciones como la preeclampsia o los partos prematuros? Un equipo internacional de científicos ha querido responder a esta pregunta mirando hacia el pasado más remoto, buceando en los orígenes del embarazo, y han demostrado por qué la gestación humana es tan especial.
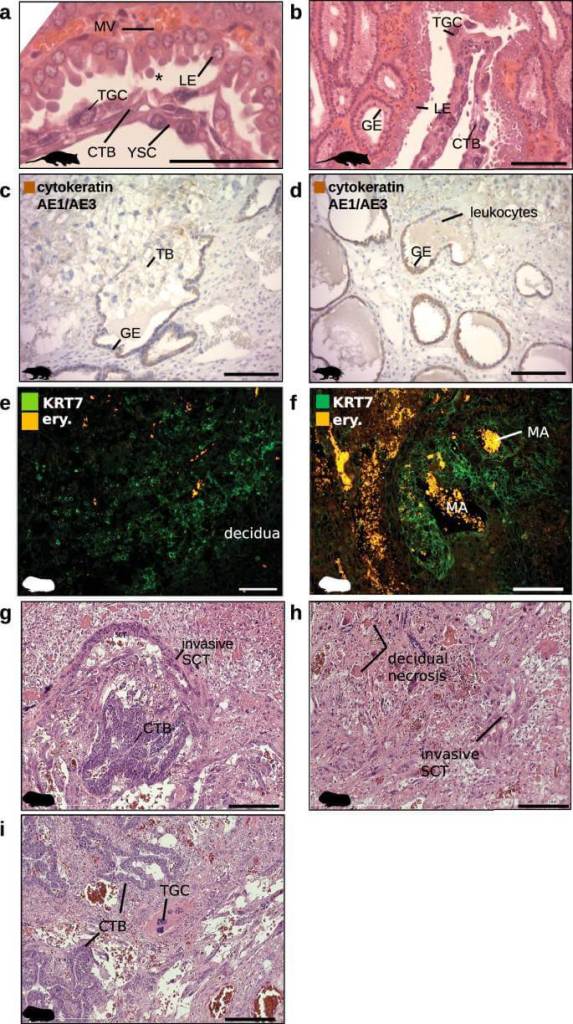
La investigación, publicada en Nature Ecology & Evolution, reconstruye la historia evolutiva del embarazo mamífero analizando más de medio millón de células individuales procedentes de seis especies clave. Entre ellas, un marsupial con placenta rudimentaria, el tenrec (un pequeño mamífero africano) y, por supuesto, los humanos.
Lo que han encontrado es tan fascinante como complejo: el embarazo tal y como lo conocemos en humanos es el resultado de al menos tres grandes innovaciones celulares que no surgieron a la vez, sino paso a paso a lo largo de millones de años: la placenta invasiva, el endometrio especializado y una comunicación molecular exquisita entre madre y feto.
Este hallazgo no solo permite entender mejor los orígenes del embarazo, sino también por qué determinadas funciones clave para la gestación son tan sensibles a alteraciones. Una información que, por cierto, puede tener implicaciones directas en áreas como la fertilidad, la salud prenatal y los vínculos tempranos madre-hijo.

Las claves del origen del embarazo
El trabajo liderado por Daniel J. Stadtmauer (Yale University), Silvia Basanta (Universidad de Viena) y Günter Wagner, entre otros, ha integrado datos de transcriptómica unicelular —el análisis de qué genes están activos en cada célula— en seis especies de mamíferos con distintos tipos de placenta y evolución reproductiva.
Los investigadores compararon células del “interface materno-fetal”, el lugar donde la placenta invade el útero y establece el diálogo con la madre. Esta zona incluye dos tipos celulares clave: el trofoblasto fetal (que construye la placenta) y las células estromales deciduales (madres, que remodelan el útero).
El equipo identificó una firma genética común en los trofoblastos invasivos de los mamíferos placentarios, pero ausente en los marsupiales. En paralelo, hallaron una célula intermedia en el tenrec —una especie con rasgos reproductivos “primitivos”— que actúa como eslabón perdido en la evolución de las células deciduales humanas.
Además, reconstruyeron las redes de comunicación molecular (ligandos y receptores) entre las células de madre y feto en ancestros extintos, lo que les permitió inferir qué señales aparecieron en qué momento y cómo se integraron para permitir la gestación tal y como la conocemos.
Conclusiones más destacadas
Una de las principales conclusiones es que el embarazo humano es una construcción evolutiva compleja, ensamblada paso a paso. El primer avance fue la aparición de células fetales capaces de invadir el útero, algo exclusivo de los mamíferos placentarios. Más tarde, la evolución dio lugar a células maternas especializadas, las deciduales, que reciben y modulan esa invasión.
Estas células, además, no solo responden, sino que se comunican activamente con el feto, y es esa coevolución de señales entre madre y bebé la que garantiza el equilibrio entre el crecimiento fetal y la salud materna.
Este “diálogo molecular” entre el feto y su madre ha sido afinado durante millones de años, pero también es especialmente sensible. Según los autores, algunas complicaciones del embarazo moderno podrían tener que ver con una desincronización de estas señales.

¿Y qué tiene esto que ver con la infancia? Todo. La forma en la que empieza la vida, el diálogo celular del embarazo, desde la implantación del embrión hasta el desarrollo del vínculo hormonal entre madre e hijo, está mediada por estos procesos celulares.
La investigación sugiere que las bases biológicas del vínculo maternofetal y de la futura salud del bebé se establecen desde etapas muy tempranas, mucho antes incluso de que podamos sentir al bebé moverse. Esto refrenda lo expuesto por otro estudio reciente que asegura que el vínculo en el embarazo influye en la relación futura con tu hijo.
Referencias
- Stadtmauer, Basanta, Maziarz et al. Cell type and cell signalling innovations underlying mammalian pregnancy. Nature Ecology & Evolution. DOI: 10.1038/s41559-025-02748-x.




