La tabla periódica, ese cuadro que representa todos los elementos químicos según sus propiedades físicas, marcó un antes y un después en el campo de estudio de las Ciencias Químicas. No solo permitió recopilar todos los elementos químicos que existen en el mundo, sino que facilitó su organización, lo cual contribuyó al descubrimiento de nuevos elementos y fomentó la investigación teórica en esta área de la ciencia. De ahí que se convirtiese en una de las herramientas más importantes de las Ciencias Químicas, un recurso que más temprano que tarde los niños y adolescentes deben dominar y saber interpretar. Se puede comenzar el acercamiento a la química con experimentos científicos como estos.
Introducción a la tabla periódica

¿Qué es la tabla periódica?
La tabla periódica es un sistema de organización que agrupa todos los elementos químicos conocidos según sus propiedades físicas y químicas. Cada elemento tiene un lugar específico en la tabla, lo que permite a los científicos y estudiantes identificar patrones y relaciones entre ellos. Esta organización es crucial para entender cómo interactúan los elementos entre sí y cómo se comportan en diferentes condiciones. La tabla no solo incluye los elementos naturales, sino también aquellos que han sido sintetizados en laboratorios, lo que la convierte en una representación completa de la química actual.
La importancia de la tabla periódica radica en su capacidad para predecir las propiedades de los elementos y sus compuestos. Al observar la disposición de los elementos, se pueden anticipar sus reacciones químicas y su comportamiento en diferentes contextos. Esta previsibilidad es una de las razones por las que la tabla periódica es una herramienta tan valiosa en la educación científica.
Además, la tabla periódica es un recurso visual que ayuda a los estudiantes a memorizar y reconocer los elementos. Al familiarizarse con su disposición, los estudiantes pueden entender mejor las relaciones entre los elementos y cómo estas afectan sus propiedades y reacciones.
Una breve historia de la tabla periódica de los elementos

El legado de Dimitri Mendeléiev
La tabla periódica de los elementos que conocemos hoy fue creada por el químico ruso Dimitri Ivánovich Mendeléiev en 1869. Sin embargo, su historia se remonta a unos años antes, a 1860. Ese año se organizó el primer Congreso Internacional de Químicos en Alemania, un evento al que acudió Mendeléiev junto a otros importantes químicos de la época. En ese contexto se estableció el concepto de peso atómico y masa atómica de un elemento, un aporte del químico italiano Stanislao Cannizzaro.
Inspirado en este concepto, Mendeléiev creo la que sería la primera versión de la tabla periódica de los elementos que conocemos hoy. Una tabla realmente revolucionaria para su tiempo ya que, además de contener predicciones, dejaba espacios vacíos para los elementos que se descubrirían más adelante como el germanio o el galio. Una propuesta que años más tarde, a comienzos del siglo XX, perfeccionó el británico Henry Moseley con su ley periódica de los elementos.
El trabajo de Mendeléiev se basó en las ideas presentadas en el Congreso Internacional de Químicos de 1860, donde se estableció el concepto de peso atómico. Este concepto fue fundamental para la organización de los elementos en la tabla, ya que proporcionó una base cuantitativa para su disposición. La visión de Mendeléiev fue posteriormente perfeccionada por Henry Moseley, quien reorganizó la tabla de acuerdo con el número atómico, lo que mejoró su precisión y utilidad.
El legado de Mendeléiev no solo reside en la creación de la tabla periódica, también en su capacidad para prever la existencia de elementos aún no descubiertos. Su trabajo sentó las bases para futuras investigaciones y descubrimientos, convirtiendo la tabla periódica en una herramienta indispensable para la química moderna.
Organización de la tabla periódica
Número atómico, períodos y grupos
La tabla periódica está organizada en función del número atómico de cada elemento, que representa la cantidad de protones en el núcleo de un átomo. Este ordenamiento permite que los elementos se dispongan de manera lógica en filas horizontales llamadas períodos y en columnas verticales conocidas como grupos. Los períodos reflejan los niveles de energía de los electrones, mientras que los grupos agrupan elementos con propiedades químicas similares.
Cada uno de los siete períodos de la tabla contiene elementos que comparten el mismo número de capas electrónicas. A medida que se avanza en un período, el número atómico de los elementos aumenta, lo que implica un aumento en el número de protones y electrones. Esta progresión afecta las propiedades físicas y químicas de los elementos, haciéndolos menos metálicos y más reactivos.
Los 18 grupos de la tabla periódica reúnen elementos con características similares. Por ejemplo, los metales alcalinos, ubicados en el grupo 1, son conocidos por su alta reactividad y baja densidad. Esta organización en grupos facilita la identificación de patrones y tendencias en las propiedades de los elementos, lo que es crucial para su estudio y aplicación en diversas áreas de la ciencia.
Datos clave de cada elemento
Cada casilla de la tabla periódica proporciona información esencial sobre un elemento específico. Los datos básicos incluyen el nombre del elemento, su símbolo químico, el número atómico y la masa atómica. Estos detalles son fundamentales para la identificación y clasificación de los elementos, permitiendo a los estudiantes y científicos comprender sus características básicas.
Las tablas periódicas más complejas ofrecen información adicional sobre cada elemento. Entre estos datos se encuentran la energía de ionización, que indica la cantidad de energía necesaria para eliminar un electrón de un átomo, y la electronegatividad, que mide la tendencia de un átomo a atraer electrones hacia sí mismo. Estos valores son cruciales para entender las reacciones químicas y las interacciones entre los elementos.
La configuración electrónica de cada elemento también se incluye en las tablas más detalladas. Esta información describe la distribución de electrones en los niveles de energía de un átomo, lo que es esencial para predecir su comportamiento químico y su reactividad. Conocer estos datos permite a los estudiantes y científicos anticipar cómo se comportará un elemento en diferentes condiciones y con otros compuestos.
Grupos de elementos en la tabla periódica

Metales alcalinos y alcalinotérreos
Los metales alcalinos, ubicados en el grupo 1 de la tabla periódica, son conocidos por su alta reactividad y su capacidad para formar compuestos iónicos con facilidad. Estos elementos, que incluyen al litio, sodio y potasio, son esenciales en diversas aplicaciones industriales y químicas. Su reactividad se debe a la presencia de un solo electrón en su capa más externa, lo que los hace propensos a perderlo y formar cationes.
Por otro lado, los metales alcalinotérreos, ubicados en el grupo 2, son menos reactivos que los alcalinos, pero aún presentan una reactividad considerable. Elementos como el magnesio y el calcio son fundamentales en procesos biológicos y en la industria. Estos metales tienen dos electrones en su capa más externa, lo que les permite formar enlaces iónicos estables con no metales.
Ambos grupos de metales son sólidos a temperatura ambiente y exhiben un brillo metálico característico. Aunque comparten algunas propiedades, sus diferencias en reactividad y estructura electrónica los hacen únicos en su comportamiento químico y en sus aplicaciones prácticas.
No metales y metaloides
Los no metales son un grupo diverso de elementos que incluyen al hidrógeno, carbono, nitrógeno y oxígeno, entre otros. Estos elementos son esenciales para la vida y desempeñan un papel crucial en la química orgánica e inorgánica. A diferencia de los metales, los no metales tienden a ganar electrones durante las reacciones químicas, lo que les confiere una alta electronegatividad.
Los metaloides, por su parte, poseen propiedades intermedias entre los metales y los no metales. Elementos como el silicio y el germanio son ejemplos de metaloides que son cruciales en la industria electrónica debido a su capacidad para conducir electricidad bajo ciertas condiciones. Esta conductividad variable los hace ideales para su uso en semiconductores y otros dispositivos tecnológicos.
La presencia de no metales y metaloides en la tabla periódica destaca la diversidad de propiedades químicas y físicas que pueden encontrarse entre los elementos. Esta diversidad es fundamental para la química, ya que permite una amplia gama de reacciones y aplicaciones en diferentes campos.
Metales de transición y postransicionales
Los metales de transición, ubicados en los grupos del 3 al 12, son conocidos por su capacidad para formar compuestos con diferentes estados de oxidación. Estos elementos, como el hierro, cobre y níquel, son altamente maleables y excelentes conductores de electricidad y calor. Su versatilidad y propiedades únicas los hacen indispensables en la industria y en la fabricación de aleaciones.
Los metales postransicionales, que se encuentran en los grupos 13 al 15, poseen propiedades metálicas pero son generalmente más blandos y menos reactivos que los metales de transición. Elementos como el aluminio, estaño y plomo son ejemplos de metales postransicionales que se utilizan ampliamente en la construcción y en la fabricación de productos químicos.
Ambos grupos de metales son esenciales para la economía global y el desarrollo tecnológico. Su capacidad para formar una variedad de compuestos y su utilidad en múltiples aplicaciones industriales subraya la importancia de su estudio y comprensión en el ámbito de la química.
Halógenos y gases nobles
Los halógenos, ubicados en el grupo 17 de la tabla periódica, son elementos altamente reactivos que incluyen al flúor, cloro, bromo y yodo. Estos elementos tienden a ganar electrones durante las reacciones químicas, formando aniones y compuestos iónicos. Su alta reactividad los convierte en agentes oxidantes potentes y en componentes clave en la producción de sales y otros compuestos.
Por otro lado, los gases nobles, que se encuentran en el grupo 18, son conocidos por su inercia química. Elementos como el helio, neón y argón son prácticamente inertes y no suelen formar compuestos bajo condiciones normales. Esta falta de reactividad se debe a su configuración electrónica estable, que les confiere una capa externa completa de electrones.
La diferencia en reactividad entre los halógenos y los gases nobles ilustra la diversidad de comportamientos químicos que se pueden observar en la tabla periódica. Esta diversidad es crucial para el estudio de la química y para la comprensión de cómo los elementos interactúan en diferentes contextos.
Características avanzadas de la tabla periódica

Energía de ionización y electronegatividad
La energía de ionización es una medida de la cantidad de energía necesaria para eliminar un electrón de un átomo en estado gaseoso. Este valor es crucial para entender la reactividad de los elementos, ya que los átomos con baja energía de ionización tienden a perder electrones fácilmente y formar cationes. En la tabla periódica, la energía de ionización generalmente aumenta de izquierda a derecha a lo largo de un período y disminuye de arriba hacia abajo en un grupo.
La electronegatividad, por su parte, es una medida de la tendencia de un átomo a atraer electrones hacia sí mismo en un enlace químico. Los elementos con alta electronegatividad, como el flúor y el oxígeno, son propensos a formar enlaces covalentes fuertes y a participar en reacciones de transferencia de electrones. La electronegatividad también sigue una tendencia en la tabla periódica, aumentando de izquierda a derecha a lo largo de un período y disminuyendo de arriba hacia abajo en un grupo.
Comprender estos conceptos avanzados es fundamental para predecir el comportamiento químico de los elementos y sus compuestos. La energía de ionización y la electronegatividad son herramientas clave para los químicos al analizar reacciones y diseñar nuevos materiales.
Configuración electrónica
La configuración electrónica describe la distribución de electrones en los niveles de energía de un átomo. Este concepto es esencial para comprender la estructura atómica y las propiedades químicas de los elementos. La configuración electrónica determina cómo interactúan los átomos entre sí y cómo se comportan en diferentes condiciones.
Cada elemento tiene una configuración electrónica única que se refleja en su posición en la tabla periódica. Los elementos en el mismo grupo comparten configuraciones electrónicas similares, lo que explica las similitudes en sus propiedades químicas. Por ejemplo, los metales alcalinos tienen un solo electrón en su capa más externa, lo que los hace altamente reactivos.
La comprensión de la configuración electrónica es crucial para el estudio de la química, ya que permite predecir cómo se comportarán los elementos en diferentes reacciones y cómo interactuarán con otros átomos. Esta información es fundamental para el diseño de nuevos compuestos y materiales con propiedades específicas.
Recursos para el aprendizaje
Tabla periódica para imprimir
La tabla periódica de los elementos es un recurso que los adolescentes tendrán que dominar en clase de Química y que les ayudará a descubrir los diferentes elementos que pueden encontrarse en la naturaleza. Una herramienta que deberán tener a mano, al menos hasta que sean capaces de memorizar y reconocer los elementos que la conforman. Una buena manera de ayudarlos a familiarizarse con la tabla periódica de los elementos consiste en imprimirles un modelo como el que os proponemos a continuación. Con la tabla en mano, estarán preparados para comprender con más detalle sus características.
Amplía aquí esta tabla periódica de los elementos.

Amplía aquí esta tabla periódica de los elementos.
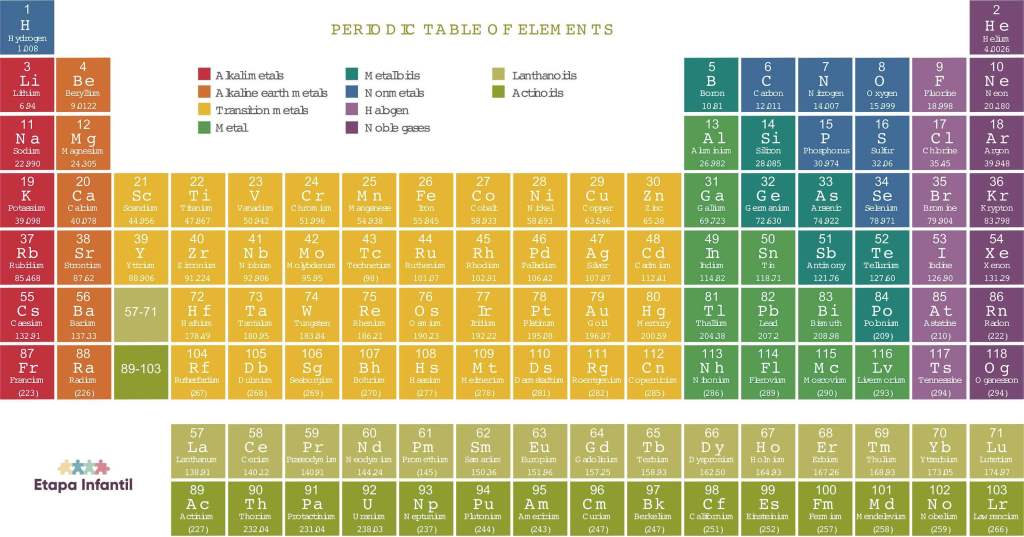
Una tabla periódica impresa es un recurso invaluable para estudiantes de química de todas las edades. Tener una representación visual de los elementos y sus propiedades ayuda a los estudiantes a familiarizarse con la estructura de la tabla y a memorizar los elementos más fácilmente. Las tablas impresas suelen incluir información básica como el nombre, símbolo, número atómico y masa atómica de cada elemento.
Algunas tablas periódicas impresas ofrecen información adicional sobre las propiedades químicas y físicas de los elementos, como la electronegatividad y la configuración electrónica. Estas tablas más detalladas son especialmente útiles para estudiantes avanzados que desean profundizar en el estudio de la química.
Contar con una tabla periódica impresa en el aula o en casa facilita el acceso rápido a la información y apoya el aprendizaje activo. Este recurso es esencial para comprender la química de manera efectiva y para desarrollar una base sólida en el estudio de los elementos y sus interacciones.
Explicación de la tabla periódica para niños
Explicar a los niños puede ser un desafío, pero es fundamental para despertar su interés por la ciencia y la química. Una buena estrategia es utilizar ejemplos y analogías simples para ilustrar cómo los elementos se organizan y cómo interactúan entre sí. Por ejemplo, se puede comparar la tabla periódica con un mapa que muestra cómo se agrupan los elementos según sus propiedades.
Es importante adaptar el lenguaje y los conceptos a la edad y nivel de comprensión de los niños. Utilizar recursos visuales, como gráficos y vídeos, puede ayudar a hacer más accesible la información y a mantener el interés de los pequeños. Es más, realizar experimentos sencillos que demuestren las propiedades de algunos elementos puede ser una forma efectiva de enseñar química de manera práctica y divertida.
Fomentar la curiosidad y el aprendizaje activo en los niños es clave para desarrollar su interés por la ciencia. Proporcionar explicaciones claras y accesibles sobre la tabla periódica les ayudará a comprender mejor el mundo que les rodea y a apreciar la importancia de la química en la vida cotidiana.




